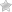1
Чеснокова Н.П. 1
Жевак Т.Н. 1
Бизенкова М.Н. 1
1 ГБОУ ВПО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Дранник Г.Н. Клиническая иммунология и аллергология. – М.: ООО «Медицинское информационное агентство», 2003. – 604 с.
2. Змушко Е.И., Белозеров Е.С., Митин Ю.А.
Клиническавя иммунология: руководство для врачей. – СПб.: Питер, 2001. – 576 с.
3. Клиническая аллергология и иммунология / Под ред. Л.А. Горячкиной, К.П. Кашкина. – М., 2009.
4. Рёкен М., Гроверс Г., Бургдорф В. Наглядная аллергология. – М., 2013. – 238 с.
5. Ярилин А.А. Иммунология. М.: ГЭОТАР – Медиа, 2010. – 752 с. 6. Abbas A.K.
Diseases of immunity / Robbins and Cotran pathologic basis of disease/ – 7th ed. / Edited by V. Kumar, A.K. Abbas, N. Fausto. – Philadelphia, Pennsylvania: Elsevier, 2005. – P. 193-267. 7. Marrack P., Kappler J., Kotzin B.L. Autoimmune disease: why and where it occurs // Nat. Med. –2001. – 7:899-905.
- Гиперчувствительность клеточного типа лежит в основе развития ряда инфекционных заболеваний (туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, герпеса, кори, грибковой инфекции), трансплантационного иммунитета, противоопухолевого иммунитета, аутоиммунных заболеваний, контактного дерматита.
- Антигенами-аллергенами, индуцирующими реакции клеточного типа, являются бактерии, грибы, простейшие, паразиты, вирусы, клетки собственных тканей организма с измененной антигенной структурой, антигены гистосовместимости, специфические антигены опухолей, комплексные антигены, образующиеся при участии гаптенов.
- Взаимодействие антигенов-аллергенов с антигенпрезентирующими клетками обеспечивается при участии Tool-рецепторов (TLR4, TLR5, TLR6, TLR62), экспрессируемых на их мембранах.
В механизмах индукции гиперчувствительности IV типа важная роль отводится антигенпрезентирующим макрофагам, дендритным и другим клеткам, обеспечивающим фагоцитирование и комплексирование негидролизованной части антигена-аллергена с белками II класса молекул МНС, а также презентацию антигена комплементарному клону Тh0. Одновременно антигенпрезентирующие клетки продуцируют цитокины (IL-12, IL-23, IL-27), обеспечивающие пролиферацию и дифференцировку антигенчувствительных клонов Th1.
Полагают, что главным цитокином в реакциях IV типа является гамма-интерферон, продуцируемый Тh1, который вызывает активацию макрофагов, вовлечение их в иммунный ответ за счет их фагоцитарной активности и уничтожения клеток-мишеней в процессе фагоцитоза, а также за счет усиления продукции монокинов с полимодальной направленностью действия.
Интерлейкин-2, продуцируемый Тh1, обеспечивает аутокринную активацию этих клеток лимфоцитов и паракринную неспецифическую пролиферацию Т-эффекторов. Антигенстимулированные Т-лимфоциты-хелперы и Т-лимфоциты-эффекторы обеспечивают продукцию медиаторов аллергии клеточного или замедленного типа, получивших название лимфокинов (рисунок).

Индукция иммунного ответа при клеточно-опосредованных реакциях
В настоящее время выделено несколько десятков лимфокинов, которые в соответствии с особенностями их биологического действия могут быть разделены на следующие группы:
1. Факторы, влияющие на лимфоциты (фактор переноса Лоуренса, митогенный фактор, фактор, стимулирующий Т- и В-лимфоциты).
2. Факторы, влияющие на макрофаги (миграцию ингибирующий фактор; фактор, активирующий макрофаги; фактор, усиливающий пролиферацию макрофагов).
3. Цитотоксические факторы (лимфотоксин; фактор, тормозящий синтез ДНК; фактор, ингибирующий гемопоэтические стволовые клетки).
4. Факторы хемотаксиса макрофагов, нейтрофилов, лимфоцитов и эозинофилов.
5. Антивирусные и антимикробные факторы.
- Многие лимфокины обладают дистантным биологическим эффектом.
- Цитотоксические CD8-Т-лимфоциты оказывают прямое действие. CD8-Т-лимфоциты обеспечивают развитие цитолиза клетки-мишени, на мембране которой фиксирован антиген, в три стадии:
- I стадия – двойного распознавания антигена в комплексе с белками МНС I класса, экспрессированными на клетке-мишени.
- II стадия – летального удара возникает в процессе контакта Т-лимфоцита-эффектора с клеткой-мишенью при участии белка перфорина, лимфотоксина или индуктора апоптоза, получаемых клеткой мишенью при межклеточном контакте.
- III стадия – стадия коллоидно-осмотического лизиса, возникающего вслед за перфорацией мембраны и пассивной диффузией ионов, а затем и высокомолекулярных соединений по осмотическому градиенту через поврежденную мембрану.
- Описание отдельных форм аллергических реакций
Контактные дерматиты.
Аллергия этого типа чаще возникает к низкомолекулярным веществам органического и неорганического происхождения: различным химическим веществам, краскам, лакам, косметическим препаратам, антибиотикам, пестицидам, соединениям мышьяка, кобальта, платины, воздействующим на кожу.
Контактные дерматиты могут вызывать также вещества растительного происхождения – семена хлопка, цитрусовые. Аллергены, проникая в кожу, образуют стабильные ковалентные связи с SH- и NН2-группами протеинов кожи. Эти конъюгаты обладают сенсибилизирующими свойствами.
Сенсибилизация обычно возникает в результате длительного контакта с аллергеном. При контактных дерматитах патологические изменения наблюдаются в поверхностных слоях кожи. Отмечаются инфильтрация воспалительными клеточными элементами, дегенерация и отслойка эпидермиса, нарушение целостности базальной мембраны.
Морфологические изменения при контактных дерматитах обусловлены фазным характером инфильтрации. Через 2-3 часа после инъекции антигена-аллергена возникает инфильтрация тканей сегментоядерными нейтрофилами.
Через 5-6 часов в периваскулярной области появляются моноциты. Через 8 часов инфильтрация моноцитами становится интенсивной. К 24–72 часам она уменьшается.
Клеточные элементы, содержащиеся в очаге воспаления, представлены в основном лимфоцитами и макрофагами.
Инфекционная аллергия. ГЗТ развивается при хронических бактериальных, вызванных грибами и вирусами инфекциях (туберкулезе, бруцеллезе, туляремии, сифилисе, бронхиальной астме, стрептококковой, стафилококковой и пневмококковой инфекциях, аспергиллезе, бластомикозе), а также при заболеваниях, вызываемых простейшими (токсоплазмоз), при глистных инвазиях.
Сенсибилизация к микробным антигенам обычно развивается при воспалении. Не исключена возможность сенсибилизации организма некоторыми представителями нормальной микрофлоры (нейссерии, кишечная палочка) или патогенными микробами при их носительстве.
Сенсибилизация к микробным антигенам в определенных условиях благоприятствует ликвидации патологического процесса. Одним из механизмов повышения устойчивости при ГЗТ может служить повышение неспецифической резистентности (усиление метаболической активности и фагоцитарной способности макрофагов, повышение активности лизоцима).
Отторжение трансплантата.
При трансплантации организм реципиента распознает чужеродные трансплантационные антигены (антигены гистосовместимости) и осуществляет иммунные реакции, ведущие к отторжению трансплантата.
Антигены главного комплекса гистосовместимости I класса локусов А, В и С есть на всех ядросодержащих клетках, а локуса G – лишь на трофобласте. Эти антигены распознаются CD8-лимфоцитами.
Антигены ГКГС II класса локусов DR, DP, DQ экспрессированы на лимфоидных, макрофагальных и эндотелиальных клетках. Они распознаются CD4-лимфоцитами.
Кроме того, на эритроцитах имеются антигены системы АВО и Rh, в почках – системы АВО. Названные антигены тоже играют определенную роль в индукции отторжения трансплантата.
Виды трансплантатов. Различают сингенные, аллогенные и ксеногенные трансплантаты.
Аллогенные и ксеногенные трансплантаты без применения иммуносупрессивной терапии отторгаются. Несмотря на появление новых, более селективных в отношении трансплантационного иммунитета иммуносупрессоров – грибковых макролидных антибиотиков (циклоспорины, FK506, рапамицин) проблема иммунологического конфликта трансплантата и реципиента еще не решена.
Механизмы отторжения трансплантата. При отторжении трансплантата наблюдается как гуморальный, так и клеточный иммунный ответ, в частности, механизмы ГЗТ, цитотоксические и иммунокомплексные реакции.
В зависимости от сроков отторжение трансплантата может быть сверхострым, острым и хроническим. Сверхострое отторжение возможно при наличии предсуществующих антител, то есть при повторной пересадке тканей от одного и того же донора, и происходит в течение первых 5 дней, а иногда в первые минуты и часы.
При остром отторжении предсуществующих антител нет. Острое отторжение – это классический вариант отторжения, в основе которого лежат как гуморальные, так и клеточные механизмы.
Такой вариант отторжения наблюдается при отсутствии или прекращении иммуносупрессирующей терапии.
Начало острого отторжения может быть отложено на несколько недель или даже месяцы, но начавшись, процесс заканчивается за несколько дней.
Отторжение считается хроническим, если в случае погрешностей в проведении иммуносупрессирующей терапии наблюдаются повторные эпизоды начинающегося отторжения трансплантата. В основе такого отторжения также лежат реакции гуморального и клеточного иммунитета. Острое и хроническое отторжение отличаются исходом – степенью облитерации сосудов.
Наиболее активны, как стимуляторы отторжения, ФНО и γ-ИФН, которые не только угнетают жизнедеятельность клеток трансплантата и активируют эффекторы цитотоксичности, но и усиливают экспрессию трансплантационных антигенов на клетках, вовлекая цитотоксические эффекторы. При отторжении активны цитотоксические CD4-положительные лимфоциты, их роль даже более значительна, чем CD8-киллеров.
При аллотрансплантации кожи, костного мозга, почки образуются гемагглютинины, гемолизины, лейкотоксины и антитела к лейкоцитам и тромбоцитам.
При реакции антиген-антитело образуются биологически активные вещества, повышающие проницаемость сосудов, что облегчает миграцию Т-киллеров в пересаженную ткань.
Лизис эндотелиальных клеток в сосудах трансплантата приводит к активации процессов свертывания крови. Кроме того, происходит активация различных фракций комплемента:
- • хемотаксические фракции – привлекают полиморфноядерные лейкоциты, которые разрушают трансплантат с помощью лизосомальных ферментов;
- • С6 компонент комплемента – активирует свертывающую систему крови;
- • С3b фракция – вызывает агрегацию тромбоцитов.
- Активация гуморального ответа в виде иммунокомплексных реакций приводит к возникновению васкулита, тромбоза и ишемического некроза.
- γ-ИФН привлекает макрофаги, которые также выделяют цитотоксические факторы.
- При отторжении по первичному типу участвуют в основном мононуклеары и лишь немного полиморфноядерных гранулоцитов, при отторжении по вторичному типу в качестве эффекторов выступают и мононуклеары, и полиморфноядерные гранулоциты.
Аутоиммунные заболевания. Развитие аутоиммунных заболеваний обусловлено сложным взаимодействием аллергических реакций клеточного и гуморального типа с преобладанием той или иной реакции в зависимости от характера аутоиммунного заболевания.
Аутоиммунные болезни представляют собой гетерогенную группу заболеваний, развитие которых связано или с доминирующей ролью цитолитических антител в механизмах деструкции клеток, или сочетанное патогенное воздействие на клетки-мишени CD8+-Т-лимфоцитов-киллеров, продуцентов лимфокинов с цитолитическими органоспецифическими или неспецифическими антителами.
Преимущественный цитотоксический эффект комплементсвязующих органоспецифических антител имеет место при аутоиммунных гемолитических анемиях, лейкопениях, тромбоцитопениях, тиреоидите Хашимото, пернициозной анемии, болезни Аддисона и других.
Между тем, в патогенезе системной и дискоидной красной волчанки, ревматоидного артрита, дерматомиозита, склеродермии, синдрома Шегрена и других форм патологии, ранее именуемых коллагенозами, ведущая роль в развитии воспалительно-деструктивных процессов в тканях отводится клеточному иммунитету. При этом антителозависимый и комплементзависимый цитолиз, патогенное действие токсических иммунных комплексов на различные органы и ткани потенцируют клеточно-опосредованные реакции.
В индукции аутоиммунных заболеваний выделяют несколько возможных механизмов:
1. Аутоиммунные поражения могут возникать в результате срыва иммунологической толерантности к собственным неизмененным тканям.
Срыв иммунологической толерантности может быть обусловлен соматическими мутациями лимфоидных клеток, что приводит либо к появлению мутантных запретных клонов Т-хелперов, обеспечивающих развитие иммунного ответа на собственные неизменные антигены.
В ряде случаев возможно образование костимулирующих молекул, модифицирующих структуру МНС антигенов, воспринимаемых лимфоидной системой как генетически чужеродное образование.
2. В последние годы важная роль в развитии аутоиммунных реакций отводится Тh17, синтезирующим ряд про- и противовоспалительных цитокинов, в частности, IL-17, GCSF, TNFα, IL-6, IL-10, IL-12 и др..
3. Образование аутоантител против естественных, первичных, антигенов-аллергенов иммунологически забарьерных тканей (нервной, хрусталика, щитовидной железы, яичек, спермы).
В эмбриональный период забарьерные антигены отделены от крови гистогематическими барьерами, препятствующими их контакту с иммунокомпетентными клетками. В результате к забарьерным антигенам не формируется иммунологическая толерантность.
При появлении в крови забарьерных антигенов против них начинают вырабатываться аутоантитела и возникает аутоиммунное поражение.
4. Образование аутоантител против приобретенных, вторичных, антигенов, образующихся под влиянием повреждающего воздействия на органы и ткани патогенных факторов неинфекционной (тепло, холод, ионизирующее излучение) и инфекционной (микробных токсинов, вирусов, бактерий) природы.
5. Образование аутоантител против перекрестно-реагирующих или гетерогенных антигенов.
Мембраны некоторых разновидностей стрептококка имеют антигенное сходство с сердечными тканевыми антигенами и антигенами базальной мембраны почечных клубочков.
В связи с этим антитела к названным микроорганизмам при стрептококковых инфекциях реагируют с тканевыми антигенами сердца и почек, приводя к развитию аутоиммунного поражения.
- Разделение аллергических реакций на несколько основных типов в определенной степени условно, поскольку многие антигены-аллергены, воздействующие на организм, являются комплексными и одномоментно вовлекают в иммунный ответ и В-систему лимфоцитов, и Т-лимфоциты-эффекторы.
- Преобладание того или иного типа аллергических реакций в патогенезе аллергического заболевания позволяет отнести его к реакциям гуморального или клеточного типов.
- Некоторые виды аутоиммунных заболеваний являются классическим примером одномоментного взаимодействия или последовательного развития аллергических реакций гуморального и клеточного типов, лежащих в основе системного или локального воспалительно-деструктивного повреждения тканей.
Библиографическая ссылка
Чеснокова Н.П., Жевак Т.Н., Бизенкова М.Н. ЛЕКЦИЯ 4 (ОСНОВНЫЕ ПОЛОЖЕНИЯ). ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО, ИЛИ КЛЕТОЧНОГО ТИПА (IV ТИП АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ) И АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ. ЭТИОЛОГИЯ, МЕХАНИЗМЫ РАЗВИТИЯ // Успехи современного естествознания. – 2014. – № 12-4. – С. 487-490;
URL: https://natural-sciences.ru/ru/article/view?id=34642 (дата обращения: 14.04.2022). 
Ранняя активация Т-клеток и Т-регуляторные лимфоциты
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов (T-reg.
Cells), соотношения Т -хелперы/Т-цитотоксические клетки и Т-клеток, несущих на своей поверхности маркер активации CD25.
Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
- Синонимы русские
- Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторные лимфоциты.
- Синонимы английские
- Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
- Метод исследования
- Проточная цитометрия.
- Какой биоматериал можно использовать для исследования?
- Венозную кровь.
- Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
- Общая информация об исследовании
- Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека — основной компонент в оценке иммунного статуса — выполняется методом проточной цитофлуориметрии.
- Иммунофенотипирование — характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD антигены (англ.
cluster of differentiation antigens) — это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера.
CD могут быть распознаны с помощью соответствующих моноклональных антител.
Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
- В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
- СD3
- Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
- — первичные и вторичные иммунодефициты;
- — острые вирусные инфекции, включая ВИЧ;
- — внутриклеточные бактериальные и паразитарные инфекционные заболевания (туберкулез, лепра, лейшманиоз);
- — злокачественные новообразования;
- — реакции отторжения трансплантатов и болезни «трансплантат против хозяина»;
- — лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
- При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
- СD4
Использование МКА к CD4 антигену дает возможность количественно охарактеризовать особый клон клеток, получивших название Т-хелперов/индукторов. СD4+ клетки в функциональном отношении делятся на два вида хелперных лимфоцитов: Т-хелперы 1-го порядка (Th1-клетки) и 2-го порядка (Th2-клетки). Различные CD4+ Т-клетки продуцируют разные наборы цитокинов.
Th1-клетки (их называют еще клетками гиперчувствительности замедленного типа – ГЗТ) – цитокины для клеточного иммунного ответа — интерлейкин 2 (IL-2), IL-3, g-IFN, TNF-a, TNF-b, — среди которых дискриминантным цитокином является g-IFN.
Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа — IL-3, 4, 5, 6, 10, 13, TNF-b, — среди которых дискриминантным цитокином является IL-4.
Определение количества CD4+ клеток имеет значение при диагностике состояний, связанных с дефектами антителопродукции и реакций клеточно-опосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
- Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
- СD8
- Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
- Клиническая значимость определения количества СD8+ лимфоцитов: вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов); при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД; злокачественные новообразования; оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований, считается, что существование какой-либо отдельной популяции Т-супрессорных клеток даже без привязки к CD8-маркеру маловероятно.
- При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
- При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
- Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
- CD25
- Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R.
Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK.
Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- соотношение Т-хелперы/ Т-цитотоксические лимфоциты (CD3+CD4+/ CD3+CD8+)
малые клеточные популяции, а также изучить их функциональную активность:
- активированные Т-лимфоциты, экспрессирующие a-цепь рецептора ИЛ-2 (CD3+CD25+CD45+);
- регуляторные Т-хелперные клетки (CD4+CD25brigCD45+), выполняющие иммуносупрессорную функцию.
- Когда назначается исследование?
- Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах — регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию «трансплантат против хозяина».
- Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза.
Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
- Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
- Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
- С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции (сепсис, гнойные менингиты).
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит.
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
- Что означают результаты?
- Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
- Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
| Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
| T-лимфоциты (CD3+CD19-) |
|
|
| Т-хелперы (CD3+CD4+CD45+) |
|
|
| Т-цитотоксические лимфоциты (CD3+CD8+CD45+) |
|
|
| T-reg. (Регуляторные Т-клетки (CD4+CD25brightCD45+) |
|
|
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Важные замечания
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Оценка показателей в динамике существенно повышает клиническую значимость исследования.
Литература
- Хаитов, Р.М. Аллергология и иммунология : национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р.М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р.М. Хаитов, Б.В. Пинегин, А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е.Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе /Е.Е Зуева, Е.Б. Русанова, А.В. Куртова, А.П. Рыжак, М.В. горчакова, О.В. Галкина – СПб. – Тверь: ООО «издательство «Триада», 2008. – 60 с.
- Кетлинский, С.А. Иммунология для врача / С.А. Кетлинский, Н.М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А.А. Иммунология : учебник / А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р.М. Иммунология : атлас / Р.М. Хаитов, А.А. Ярилин, Б.В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р.М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р.М. Оценка иммунного статуса человека в норме и при патологии / Р.М. Хаитов, Б.В. Пинегин // Иммунология. – 2001. – N4. – С. 4–6.
- Whiteside, T.L. Role of Human Natural Killer Cells in Health and disease / T.L. Whiteside, R.B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125–133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539–544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337–1343.
- Никитин, В.Ю. Маркеры активации на Т-хелперах и цитотокси ческих лимфоцитахна различных стадиях хронического вирусного гепатита С / В.Ю. Никитин, И.А. Сухина, В.Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65–71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. − 2005. − Vol. 79, N 12. −P. 7860–7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. − 2005. − Vol. 65, N 6. − P. 2457–2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. − 2005. −Vol. 6, N 4. − P. 345–352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. –2006. − Vol. 36. − P. 1357–1366.
- Хайдуков С.В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) /Хайдуков С.В., Зурочка А.В., Тотолян А.А., Черешнев В.А. // Мед. иммунология. — 2009. -Т. 11 (2-3). — С. 227-238.
Т-клеточные иммунодефициты
Источник: Melisa E. Elder, / T-CELL IMMUNODEFICIENCIES / PEDIATRIC CLINICS OF NORTH AMERICA VOL.47. N 6.
Первичные Т-клеточные дефициты — это редкие наследственные нарушения, поражающие развитие и функцию Т-клеток.
Эти нарушения обычно проявляются в грудном или раннем детском возрасте; однако, возраст появления симптомов может варьировать в зависимости от в основе лежащего генного дефекта.
Хотя Т-клеточные иммунные реакции могут быть нарушены селективно, тем не менее, с этим часто ассоциируют ненормальные В-клеточные функции, отчасти из-за сопутствующих внутренних В-клеточных дефектов, но также и потому, что выработка большинства антител зависит от помощи Т-клеток.
ТЯЖЕЛЫЕ КОМБИНИРОВАННЫЕ СИНДРОМЫ ИММУНОДЕФИЦИТА
Тяжелые комбинированный иммунодефицитный синдром (SCID) — это наследственное нарушение у детей, характеризующееся глубоко дефективной или отсутствием Т клеточной и В клеточной функций.
SCID часто оказывается фатальным в течение первого года жизни, несмотря на проведение терапевтической трансплантации стволовых клеток или в случае дефицита аденозин деаминазы (ADA) про-веденного замещения фермента.
Ранее выявление пораженных пациентов до развития у них оппорту-нистических инфекций является критическим для достижении благоприятного исхода. Диагноз SCID считается подтвержденным, когда у пораженного ребенка определяется лимфопения (75%) В лимфоцитов (табл.2).
Уровни IgG и IgA в сыворотке чрезвычайно низки и специфическая выработка антител отсутствует. И наоборот, уровни IgM и IgE в сыворотке могут оказаться нормальными в ре-зультате материнского Т-клеточного внедрения. In vitro Т-клеточная и NK-клеточная функции оказы-ваются, как правило, слабыми.
У большинства детей пораженных XSCID присутствуют определяемые при HLA типировании материнские Т лимфоциты в их крови. Явный GVHD может развиться, если присутствует значительное количество материнских Т клеток, способных реагировать на полученные от родителей HLA антигены. Наличие лимфоцитоза, нормальные уровни IgM и IgE, гепатомегалия, лимфаденопатия и хронической сыпи в результате материнской GVHD часто задерживают выявление XSCID.
Множественные различные мутации в гене IL2RG были идентифицированы у XSCID потомков. В от-личие от кистозного фиброза ни одной обычной мутации не происходит при XSCID; тем не менее, не-которые «hot spots» были идентифицированы в гене, в котором часто идентифицируются мутации.
Как было показано, некоторые мутации оказывают относительно слабые воздействия на функцию gс; у таких пациентов имеется тенденция к меньшей лимфопении, лучше сохраняемой Т-клеточной функ-ции и более близким к норме уровням в сыворотке Ig.
Эти дети часто классифицируются, как имею-щие неизвестный AR T+ B+ SCID, задерживающий распознание их в основе лежащего генетического дефекта. Так как в большинстве XSCID семей имеются отдельные мутации, то последовательные анализы кодирующих регионов гена IL2RG должны производиться для характеристики вредных мута-ций.
Секвенсирование материнской ДНК также может осуществляться для подтверждения мутаций; однако, у более, чем 50% пациентов мужского пола с XSCID имеется спонтанно возникшая IL2RG му-тация без доказательства наследственной мутантной материнской Х хромосомы при секвенировании ДНК или при не слепом характере инактивации Х хромосомы.
Гистосовместимый или гаплоидентич-ный ВМК или трансплантация периферической или стволовой клетки пупочного канатика дают иммунную реконституцию у большинства мальчиков с XSCID. In utero ВМТ успешно лечит пораженные пло-ды, а генная терапия кажется должна стать реальной возможностью
JAK3 энзимный дефицит
У девочек и некоторых мальчиков с типичным T-B+NK- SCID фенотипом отсутствуют мутации в IL2RG гене. Эти пациенты, многие из которых рождены от родителей родственников, вместо этого имеют AR SCID вызванный мутациями в обеих аллелях JAK3 энзима.
Дефицит JAK3 энзима был впервые опи-сан в 1995 году и на него может приходиться от 10 до 20% всех случаев SCID. JAK3 — это цитоплазма-тическая тирозин киназа, которая связана с gс и необходима для трансдукции цитокин-связанных сигналов с gс-содержащих цитокиновых рецепторов.
Мутации в JAK3 препятствуют прохождению сигнала через эти рецепторы, подтверждая тем самым наблюдение, что gс функция находится в абсолютной зависимости от активации JAK3, располагающихся ниже по току прохождения сигнала. JAK3 мутации различны и имеют тенденцию быть уникальными для каждого отдельного семейства.
Многие исклю-чают JAK3 mRNA или протеиновую экспрессию, но описаны исключения, которые проявляются более слабо выраженным фенотипом SCID и выработкой некоторых Т и NK клеток.
Дефицит интерлейкин-7 рецептора
Дефекты цепи a IL-7-рецептора (IL-7Ra) представляют собой редкие причины AR SCID. Фенотип IL-7Ra дефицита схож с таковым XSCID и JAK3 дефицитом при существенном исключении. В отличие от этих иммунных дефектов IL-7Ra дефицит не приостанавливает развитие NK-клеток и рассматрива-ется как T- B- NK+ форма SCID.
Дефицит интерлейкина-2
Были опубликованы сообщения об отдельных семьях с дефектами в выработке IL-2. У пациентов с IL-2 дефицитом сохраняются относительно нормальные количества периферических лимфоцитов (T+ B+ SCID) и гипогаммальбуминемия.
In vitro функция Т-клеток снижена, но поддается коррективроке при добавлении рекомбинанта IL-2. В основе лежащие генетические дефекты у этих пациентов неизвестны, но как считается, они поражают регуляцию транскрипции гена IL-2.
Парентеральная терапия ре-комбинантом IL-2 может дать частичную иммунную реконституцию у этих пациентов.
Дефицит RAG 1 и 2
Дети с дефектами лимфоцито-специфическими рекомбиназа-активирующими генами (RAG) 1 или 2 (RAG1 и RAG2) были впервые описаны в 1996 году. RAG 1 или RAG 2 проявляются первичной фор-мой T-B-NK+ SCID и на них может приходиться от 10 до 20% всех случаев.
Функция RAG 1 и RAG 2 незаменима для поколений Т-клеточных и В-клеточных антигенных рецепторов (TCR и BCR, соответ-ственно).
Во время Т-клеточного и В-клеточного онтогенеза хромосомальная ДНК содержащая раз-личные вариабельные (V), диверсивные (D) и добавочные (J) сегменты TCR генов иммуноглобулина перестраивается для выработки функциональных антигенных рецепторов.
V(D)J рекомбинация дает диверсиновсть антигенного рецептора и способность иммунной системе человека реагировать на бо-лее, чем 108 антигенов.
Неспособность совершать V(D)J рекомбинацию проявляется в остановке со-зревания Т-клеток и В-клеток на ранней стадии лимфоцитарной дифференцировки при полном отсут-ствии всех Т и В клеток и агаммаглобулинемией. NK клетки не экспрессируют антиген-специфических рецепторов и их развитие не нарушается при дефективной RAG-1 или RAG-2 функции. Мутации как в RAG1, так и в RAG2 были идентифицированы у потомком лиц с T-B-NK+ SCID. Тяжелые RAG1 мута-ции развиваются во внутренних фрагментах протеина и могут оказаться более частыми, чем отклоне-ния в RAG2.
Синдром Omenn’a (OS)
OS — это редкое AR нарушение, описанное в 1965 году Omenn, как SCID, характеризующийся следующими симптомами :
-
Физикальные данные
-
Эритродерма
-
Лимфаденопатия
-
Гепатоспленомегалия
-
Неспособность набора веса вторичная к диарее
-
Генерализированный отек
-
Лихорадка
-
Лабораторные данные
-
Гипоальбуминемия
-
Эозинофилия (>1000 клеток на мм3)
-
Изменяющееся число лимфоцитов
-
От сниженного до повышенного количество CD3+ Т клеток
-
Отсутствие В клеток
-
Нормальное количество NK клеток
-
Явно дефективная Т-клеточная и В-клеточная функции
-
Гипогаммаглобулинемия
-
Существенного пониженные уровни IgG, IgM и IgA
-
Гипер-IgE (>1000 IU/mL)
В 1998 году у пациентов с OS были идентифицированы мутации в RAG1 или RAG2, проявлявшиеся в частичной V(D)J активности рекомбиназы и развитием редко активированных, но анергичных, олиго-клональных Т клеток.
Эти клинические проявления характерны для OS и отличают его от других форм SCID. В течение многих лет считалось, что OS является тяжелым вариантом материнского GVHD, но внедренных ма-теринских Т лимфоцитов определить не удалось. У пораженных детей количество периферических Т лимфоцитов оказывалось от существенного сниженного до нормального уровней.
Во многих случаях количество CD3+ Т лимфоцитов оказывалось нормальным, но отсутствовали циркулирующие В клет-ки. Иммуноглобулины сыворотки не определялись, за исключением существенного повышенного уров-ня IgE (часто >1000 IU/mL). Также как при полном дефиците RAG 1 или 2 дефиците, количество NK клеток остается нормальным у пациентов с OS.
OS рассматривается как T- B- NK+ форма SCID, но на-личие олигоклональных Т клеток, которые развиваются благодаря редким успешным V(D)J рекомби-национным проявлениям, путает диагноз.
Гипер IgE обусловлен наличием в не-лимфоидных тканях редких В клеток, которые простимулированы на выработку IgE клетками хелперами, направленными на выработку IL-4 IL-5 и обычно встречающихся при гиперчувствительности или аллергических забо-леваниях. Наличие лимфаденопатии отличает OS от других форм SCID без материнской GVHD.
Гис-тологическое исследование лимфатических узлов при OS выявляет нарушение архитектуры, отсутст-вие образования фолликул и чрезмерную инфильтрацию эозинофилами, гистиоцитами и активиро-ванными Т клетками. Кожа также массивно инфильтрирована воспалительными клетками.
Анализ секвенции ДНК у пациентов с OS обнаруживает мутации в RAG1 или RAG2, которые не пол-ностью устраняют V(D)J активность рекомбиназы.
По неизвестным причинам частичная RAG1 или RAG2 функция проявляется в более продуктивной перестройке TCR, чем BCR, так олигоклональные Т клетки присутствуют, а циркулирующие В клетки очень редки. Интересно, что большинство поражен-ных детей рождены от родителей не имеющих родственных связей.
До ВМТ, необходимо исключить материнскую GVHD. Эти дети также часто оказываются тяжело больными с лихорадкой, протеин-теряющей энтеропатией и генерализованным отеком из-за воспаления кишечника и кожи.
Аблативная хемотерапия и иммуносупрессия необходимы для предотвращения отторжения трансплантанта акти-вированными аутологичными Т лимфоцитами. Предпочтение отдается ткане-совместимой ВМТ, так у пациентов с OS повышен риск неудачи гаплоидентичной трасплантации.
Тяжелый комбинированный Navajo синдром
Navajo SCID — это AR мутация случающаяся приблизительно у 1 из 2000 живых новорожденных у Ath-abascan Native Americans. В основе лежащий генетический дефект остается неизвестным но маппиру-ется на хромосоме 10р при проведении анализа потомков.
Клинические проявления Navajo SCID сходны с таковыми при других формах SCID за исключением необычного явления наблюдаемого у большинства пациентов в течение первых 4 месяцев жизни — не связанного с вирусом герпеса ораль-ных и генитальных язв. Пораженные дети дают лимфопению (300-1800 клеток на мм3), при количест-ве Т и В клеток менее, чем 200 клеток на мм3.
In vitro функция Т клеток и уровни сывороточного имму-ноглобулина существенно снижены, в то время, как NK клетки имеются в избытке и их активность нормальна, поэтому Navajo SCID класссифицируется как T- B- NK+ SCID, но не связанный с дефектив-ной RAG-1 или RAG-2 функцией.
Наличие NK активности осложняет проведение ВМТ увеличивая риск отторжения трансплантанта. Интенсивное пре-ВМТ аблативное кондиционирование необходимо для осуществления трансплантации у пораженных детей.
Дефицит аденозин деаминазы
На дефицит ADA приходится приблизительно 15% всех случаев SCID. Впервые он был описан в 1972 году.
В отличие от других форм SCID, при которых мутации специфически поражают Т- клеточные и часто В- клеточные функции, ADA дефицит проявляется метаболическим отравлением всех клеток, с наиболее выраженными воздействиями на лимфоциты и лимфоидные прогениторы. ADA дефицит — это наиболее частая форма T- B- NK- SCID.
ADA — это широко распространенный энзим пути расщепления пуринов, который катализирует деами-нацию аденозина и деоксиаденозина в инозин и в деоксиинозин. Отсутствие ADA проявляется накоп-лением этих субстратов интрацеллюлярной и в экстрацеллярной жидкостях.
Значительно повышен-ный уровень деоксиаденозин трифосфата в лимфоцитах связан с интрацеллюлярным захватом и фосфориляцией деоксиаденозина, что может объяснить почему лимфоциты так чувствительны к ток-сичным побочным эффектам этих метаболитов.
Аденозин, деоксиаденозин и деоксиаденозин три-фосфат ингибируют различные клеточные процессы, включая активность рибонуклеоитидной редук-тазы, что приводит к смерти клетки и повреждению тканей.
Активность эритроцитарной ADA, как пра-вило, измеряется при постановке диагноза ADA дефицита, но обычно оказывается ниже, чем в лим-фоцитах.
Клинический и лабораторный спектр дефицита ADA довольно широк и зависит от тяжести лежащих в основе генных мутаций.
Скрининг большой группы здоровых взрослых показал, что 7% или более нормальной активности эритроцитарной ADA ассоциирует с интактным иммунитетом; поэтому SCID и менее тяжелые иммунные дефекты при дефиците ADA связаны с мутациями в гене ADA, которые устраняют или почти полностью выключают функцию энзима.
Приблизительно у 80% пациентов име-ет место его раннее начало, классический дефицит ADA и развитие в первые 3 месяца жизни.
Отли-чительной клинической характеристикой у приблизительно 50% этих пациентов являются скелетные аномалии, первичные образование чашеобразных углублений (cupping) и постепенное сведение на нет или распространение наружу (flaring) костохондральных соединений видимых на рентгенограмме грудной клетке. Эти пациенты сохраняют 0,01% или менее активности ADA, у них имеется алимфоци-тоз (